Menurut teori asam basa arrhenius asam adalah.
Jika kamu sedang mencari artikel menurut teori asam basa arrhenius asam adalah terlengkap, berarti kamu telah berada di blog yang tepat. Yuk langsung aja kita simak pembahasan menurut teori asam basa arrhenius asam adalah berikut ini.
 Teori Asam Basa Arrhenius Bronsted Lowry Lewisdari Ketiga Definisi Teori Tsb Manakah Yg Cakupannya Brainly Co Id From brainly.co.id
Teori Asam Basa Arrhenius Bronsted Lowry Lewisdari Ketiga Definisi Teori Tsb Manakah Yg Cakupannya Brainly Co Id From brainly.co.id
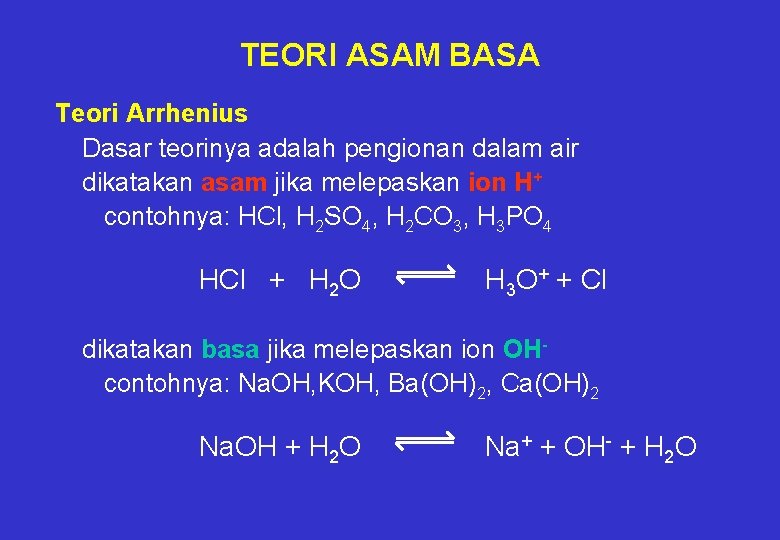
Asam kuat diantaranya HCl HBr HI H2SO4 HNO3 dan HClO4. Asam ialah proton donor sedangkan basa adalah proton akseptorTeori asam basa dari Arrhenius ternyata tidak dapat berlaku untuk semua pelarut karena khusus untuk pelarut air. Menurut teori asam basa Arrhenius asam kuat merupakan asam yang derajat ionisasinya besar atau mudah terurai dan banyak menghasilkan ion H dalam larutannya. Zat yang dalam air menerima ion OH -.
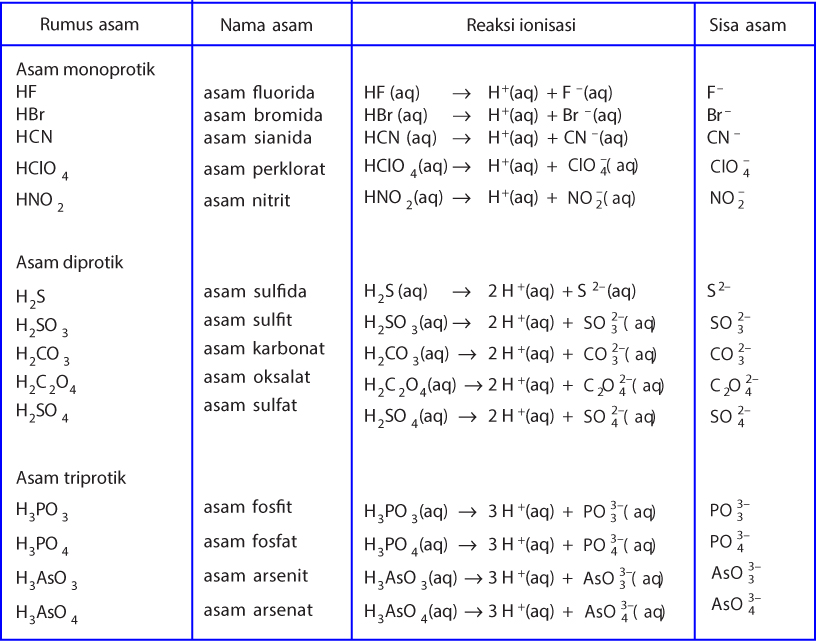
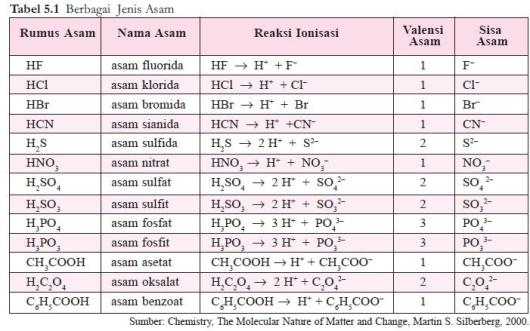
Asam poliprotik yaitu asam yang memiliki dua atau tiga valensi asam polivalen.
Asam poliprotik yaitu asam yang memiliki dua atau tiga valensi asam polivalen. Svante Arrhenius penemu teori asam basa pertama. Dikemukakan pertama kali oleh ilmuwan bernama Svante August Arrhenius pada tahun 1884 teori ini menyatakan bahwa senyawa asam adalah senyawa yang melepaskan ion H atau ion hidronium H 3 O jika dilarutkan ke dalam air sedangkan senyawa basa adalah senyawa yang akan melepaskan ion OH jika dilarutkan ke dalam air. Menurut Arrhenius definisi pada asam dan basa sebagai berikut. Asam ialah proton donor sedangkan basa adalah proton akseptorTeori asam basa dari Arrhenius ternyata tidak dapat berlaku untuk semua pelarut karena khusus untuk pelarut air.
 Source: anyflip.com
Source: anyflip.com
Basa adalah zat yang dapat melepaskan ion OH di dalam. Basa merupakan suatu senyawa yang jika dilarutkan dalam air menyatakan ion OH. Fakta ini memicu Arrhenius untuk mengajukan teori asam basa. Asam kuat diantaranya HCl HBr HI H2SO4 HNO3 dan HClO4. H2SO4 H2S H3PO3 7.
Menurut Arrhenius asam adalah zat yang dapat melepaskan ion H di dalam air sehingga konsentrasi ion H dalam air meningkat.
Asam kuat diantaranya HCl HBr HI H2SO4 HNO3 dan HClO4. Asam ialah proton donor sedangkan basa adalah proton akseptorTeori asam basa dari Arrhenius ternyata tidak dapat berlaku untuk semua pelarut karena khusus untuk pelarut air. Asam merupakan suatu senyawa yang jika dilarutkan dalam air menyatakan ion H. Macam-macam asam menurut teori Arrhenius.
 Source: brainly.co.id
Source: brainly.co.id
Pengertian asam basa Lewis Menurut Lewis yang dimaksud dengan asam adalah asam adalah suatu molekul atau ion yang dapat menerima pasangan elektron atau akseptor elektron sedangkan basa adalah suatu molekul atau ion yang dapat memberikan pasangan elektronnya atau donor elektron. Svante Arrhenius penemu teori asam basa pertama. Pada tahun 1923 ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan donor atau menerima akseptor proton ion H. Fakta ini memicu Arrhenius untuk mengajukan teori asam basa.
 Source: slideplayer.info
Source: slideplayer.info
Basa adalah zat yang dapat melepaskan ion OH di dalam. Pengertian Asam Basa Arrhenius Larutan asam dan basa disebut juga dengan senyawa elektrolit. Menurut Arrhenius definisi pada asam dan basa sebagai berikut. Pengertian Asam Basa Arrhenius Asam basa Arrhenius merupakan teori asam basa yang dikenal paling tua diantara yang lainnya.
 Source: slideshare.net
Source: slideshare.net
Pengertian Asam Basa Arrhenius Larutan asam dan basa disebut juga dengan senyawa elektrolit. Pengertian Asam Basa Arrhenius Asam basa Arrhenius merupakan teori asam basa yang dikenal paling tua diantara yang lainnya. Asam ialah proton donor sedangkan basa adalah proton akseptorTeori asam basa dari Arrhenius ternyata tidak dapat berlaku untuk semua pelarut karena khusus untuk pelarut air. Zat yang dalam air melepaskan ion OH -.
H2SO4 H2S H3PO3 7. Menurut konsep Bronsted dan Lowry zat yang memiliki kecenderungan untuk menyumbangkan ion H pada zat lain adalah asam. Asam merupakan suatu senyawa yang jika dilarutkan dalam air menyatakan ion H. Asam kuat diantaranya HCl HBr HI H2SO4 HNO3 dan HClO4.
Menurut teori asam basa Arrhenius asam kuat merupakan asam yang derajat ionisasinya besar atau mudah terurai dan banyak menghasilkan ion H dalam larutannya.
Dikemukakan pertama kali oleh ilmuwan bernama Svante August Arrhenius pada tahun 1884 teori ini menyatakan bahwa senyawa asam adalah senyawa yang melepaskan ion H atau ion hidronium H 3 O jika dilarutkan ke dalam air sedangkan senyawa basa adalah senyawa yang akan melepaskan ion OH jika dilarutkan ke dalam air. Dikemukakan pertama kali oleh ilmuwan bernama Svante August Arrhenius pada tahun 1884 teori ini menyatakan bahwa senyawa asam adalah senyawa yang melepaskan ion H atau ion hidronium H 3 O jika dilarutkan ke dalam air sedangkan senyawa basa adalah senyawa yang akan melepaskan ion OH jika dilarutkan ke dalam air. Zat yang dalam air menerima ion OH -. Asam kuat diantaranya HCl HBr HI H2SO4 HNO3 dan HClO4. H2SO4 H2S H3PO3 7.
 Source: teamhannamy.blogspot.com
Source: teamhannamy.blogspot.com
Menurut konsep Bronsted dan Lowry zat yang memiliki kecenderungan untuk menyumbangkan ion H pada zat lain adalah asam. Basa adalah zat yang dapat melepaskan ion OH di dalam. Pada tahun 1923 ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan donor atau menerima akseptor proton ion H. Senyawa asam basa tersebut banyak ditemukan dalam. Menurut Arrhenius definisi pada asam dan basa sebagai berikut.
Basa adalah zat yang dapat melepaskan ion OH di dalam. Menurut teori asam basa Arrhenius asam kuat merupakan asam yang derajat ionisasinya besar atau mudah terurai dan banyak menghasilkan ion H dalam larutannya. TEORI ASAM BASA BRONSTED-LOWRY Pada tahun 1923 Johannes Bronsted Denmark dan Thomas Lowry Inggris. Pengertian asam basa Lewis Menurut Lewis yang dimaksud dengan asam adalah asam adalah suatu molekul atau ion yang dapat menerima pasangan elektron atau akseptor elektron sedangkan basa adalah suatu molekul atau ion yang dapat memberikan pasangan elektronnya atau donor elektron.
Asam merupakan suatu senyawa yang jika dilarutkan dalam air menyatakan ion H.
Pengertian asam basa Lewis Menurut Lewis yang dimaksud dengan asam adalah asam adalah suatu molekul atau ion yang dapat menerima pasangan elektron atau akseptor elektron sedangkan basa adalah suatu molekul atau ion yang dapat memberikan pasangan elektronnya atau donor elektron. Menurut Arrhenius asam adalah zat yang dapat melepaskan ion H di dalam air sehingga konsentrasi ion H dalam air meningkat. Di artikel ini akan dibahas lebih dalam mengenai asam basa arrhenius. Asam Arrhenius adalah zat yang melepaskan ion hidronium H pada larutan sedangkan basa adalah zat yang melepaskan ion hidroksida OH pada larutan.
 Source: kimia-science7.com
Source: kimia-science7.com
Menurut konsep Bronsted dan Lowry zat yang memiliki kecenderungan untuk menyumbangkan ion H pada zat lain adalah asam. Asam merupakan suatu senyawa yang jika dilarutkan dalam air menyatakan ion H. Pengertian asam basa Lewis Menurut Lewis yang dimaksud dengan asam adalah asam adalah suatu molekul atau ion yang dapat menerima pasangan elektron atau akseptor elektron sedangkan basa adalah suatu molekul atau ion yang dapat memberikan pasangan elektronnya atau donor elektron. Menurut teori asam basa Arrhenius basa adalah.
 Source: qanda.ai
Source: qanda.ai
H2SO4 H2S H3PO3 7. Zat yang dalam air melepaskan ion H. Pengertian Asam Basa Arrhenius Asam basa Arrhenius merupakan teori asam basa yang dikenal paling tua diantara yang lainnya. Svante Arrhenius penemu teori asam basa pertama.
 Source: slideshare.net
Source: slideshare.net
Pada tahun 1923 ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan donor atau menerima akseptor proton ion H. Senyawa asam basa tersebut banyak ditemukan dalam. Asam monoprotik yaitu asam yang memiliki satu valensi asam monovalen. Menurut teori asam basa Arrhenius basa adalah.
Fakta ini memicu Arrhenius untuk mengajukan teori asam basa.
Dikemukakan pertama kali oleh ilmuwan bernama Svante August Arrhenius pada tahun 1884 teori ini menyatakan bahwa senyawa asam adalah senyawa yang melepaskan ion H atau ion hidronium H 3 O jika dilarutkan ke dalam air sedangkan senyawa basa adalah senyawa yang akan melepaskan ion OH jika dilarutkan ke dalam air. Zat yang dalam air melepaskan ion H. Svante Arrhenius penemu teori asam basa pertama. Begitu juga tidak sesuai dengan reaksi penggaraman karena tidak semua garam bersifat netral tetapi ada juga yang bersifat asam dan ada yang bersifat basa. Menurut teori asam basa Arrhenius basa adalah senyawa yang di dalam air larutan dapat menghasilkan ion OH.
 Source: slideplayer.info
Source: slideplayer.info
Menurut teori asam basa Arrhenius basa adalah. Basa adalah zat yang dapat melepaskan ion OH di dalam. Asam monoprotik yaitu asam yang memiliki satu valensi asam monovalen. Di artikel ini akan dibahas lebih dalam mengenai asam basa arrhenius. Pengertian asam basa Lewis Menurut Lewis yang dimaksud dengan asam adalah asam adalah suatu molekul atau ion yang dapat menerima pasangan elektron atau akseptor elektron sedangkan basa adalah suatu molekul atau ion yang dapat memberikan pasangan elektronnya atau donor elektron.
TEORI ASAM BASA BRONSTED-LOWRY Pada tahun 1923 Johannes Bronsted Denmark dan Thomas Lowry Inggris.
Dikemukakan pertama kali oleh ilmuwan bernama Svante August Arrhenius pada tahun 1884 teori ini menyatakan bahwa senyawa asam adalah senyawa yang melepaskan ion H atau ion hidronium H 3 O jika dilarutkan ke dalam air sedangkan senyawa basa adalah senyawa yang akan melepaskan ion OH jika dilarutkan ke dalam air. Secara singkat dapat dikatakan bahwa keterbatasan teori Arrhenius adalah bahwa reaksi asam basa hanyalah sebatas pada larutan berair aqueus aq dan asam-basa adalah zat yang hanya menghasilkan H dan OH-. Menurut konsep Bronsted dan Lowry zat yang memiliki kecenderungan untuk menyumbangkan ion H pada zat lain adalah asam. Svante Arrhenius penemu teori asam basa pertama.
 Source: tobavodjit.blogspot.com
Source: tobavodjit.blogspot.com
Zat yang dalam air dapat menerima ion H. Pengertian Asam Basa Arrhenius Larutan asam dan basa disebut juga dengan senyawa elektrolit. Zat yang dalam air menerima ion OH -. Zat yang dalam air melepaskan ion H.
 Source: kiospelajar.blogspot.com
Source: kiospelajar.blogspot.com
Begitu juga tidak sesuai dengan reaksi penggaraman karena tidak semua garam bersifat netral tetapi ada juga yang bersifat asam dan ada yang bersifat basa. Basa merupakan suatu senyawa yang jika dilarutkan dalam air menyatakan ion OH. Basa adalah zat yang dapat melepaskan ion OH di dalam. Zat yang dalam air melepaskan ion H.
 Source: myrightspot.com
Source: myrightspot.com
Pengertian asam basa Lewis Menurut Lewis yang dimaksud dengan asam adalah asam adalah suatu molekul atau ion yang dapat menerima pasangan elektron atau akseptor elektron sedangkan basa adalah suatu molekul atau ion yang dapat memberikan pasangan elektronnya atau donor elektron. Asam monoprotik yaitu asam yang memiliki satu valensi asam monovalen. H2SO4 H2S H3PO3 7. Menurut konsep Bronsted dan Lowry zat yang memiliki kecenderungan untuk menyumbangkan ion H pada zat lain adalah asam.
TEORI ASAM BASA BRONSTED-LOWRY Pada tahun 1923 Johannes Bronsted Denmark dan Thomas Lowry Inggris.
Asam ialah proton donor sedangkan basa adalah proton akseptorTeori asam basa dari Arrhenius ternyata tidak dapat berlaku untuk semua pelarut karena khusus untuk pelarut air. Menurut konsep Bronsted dan Lowry zat yang memiliki kecenderungan untuk menyumbangkan ion H pada zat lain adalah asam. Zat yang dalam air menerima ion OH -. Menurut teori asam basa Arrhenius basa adalah. Menurut Arrhenius definisi pada asam dan basa sebagai berikut.
 Source: sites.google.com
Source: sites.google.com
Begitu juga tidak sesuai dengan reaksi penggaraman karena tidak semua garam bersifat netral tetapi ada juga yang bersifat asam dan ada yang bersifat basa. Dikemukakan pertama kali oleh ilmuwan bernama Svante August Arrhenius pada tahun 1884 teori ini menyatakan bahwa senyawa asam adalah senyawa yang melepaskan ion H atau ion hidronium H 3 O jika dilarutkan ke dalam air sedangkan senyawa basa adalah senyawa yang akan melepaskan ion OH jika dilarutkan ke dalam air. Asam Arrhenius adalah zat yang melepaskan ion hidronium H pada larutan sedangkan basa adalah zat yang melepaskan ion hidroksida OH pada larutan. Macam-macam asam menurut teori Arrhenius. Pada tahun 1923 ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan donor atau menerima akseptor proton ion H.
H2SO4 H2S H3PO3 7.
Menurut teori asam basa Arrhenius basa adalah. Pengertian Asam Basa Arrhenius Asam basa Arrhenius merupakan teori asam basa yang dikenal paling tua diantara yang lainnya. Menurut Arrhenius asam adalah zat yang dapat melepaskan ion H di dalam air sehingga konsentrasi ion H dalam air meningkat. Pengertian Asam Basa Arrhenius Larutan asam dan basa disebut juga dengan senyawa elektrolit.
 Source: brainly.co.id
Source: brainly.co.id
Basa merupakan suatu senyawa yang jika dilarutkan dalam air menyatakan ion OH. Basa merupakan suatu senyawa yang jika dilarutkan dalam air menyatakan ion OH. Menurut teori asam basa Arrhenius asam kuat merupakan asam yang derajat ionisasinya besar atau mudah terurai dan banyak menghasilkan ion H dalam larutannya. Zat yang dalam air dapat menerima ion H. Pengertian Asam Basa Arrhenius Larutan asam dan basa disebut juga dengan senyawa elektrolit.
 Source: slidetodoc.com
Source: slidetodoc.com
H2SO4 H2S H3PO3 7. Pengertian asam basa Lewis Menurut Lewis yang dimaksud dengan asam adalah asam adalah suatu molekul atau ion yang dapat menerima pasangan elektron atau akseptor elektron sedangkan basa adalah suatu molekul atau ion yang dapat memberikan pasangan elektronnya atau donor elektron. Menurut teori asam basa Arrhenius asam kuat merupakan asam yang derajat ionisasinya besar atau mudah terurai dan banyak menghasilkan ion H dalam larutannya. Senyawa asam basa tersebut banyak ditemukan dalam. Zat yang dalam air melepaskan ion H.
 Source: anyflip.com
Source: anyflip.com
Begitu juga tidak sesuai dengan reaksi penggaraman karena tidak semua garam bersifat netral tetapi ada juga yang bersifat asam dan ada yang bersifat basa. Asam merupakan suatu senyawa yang jika dilarutkan dalam air menyatakan ion H. Menurut Arrhenius asam adalah zat yang dapat melepaskan ion H di dalam air sehingga konsentrasi ion H dalam air meningkat. Pada tahun 1923 ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan donor atau menerima akseptor proton ion H. H2SO4 H2S H3PO3 7.
Situs ini adalah komunitas terbuka bagi pengguna untuk menuangkan apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini bermanfaat, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga save halaman blog ini dengan judul menurut teori asam basa arrhenius asam adalah dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.





